2022年9月1日,复旦大学放射医学研究所邵春林教授团队在Nature旗下《British Journal of Cancer》上在线发表题为“Exosomal protein angiopoietin-like 4 mediated radioresistance of lung cancer by inhibiting ferroptosis under hypoxic microenvironment”的研究论文,发现乏氧肺癌细胞外泌体可抑制周围富氧肺癌细胞的铁死亡,从而诱导其产生辐射抵抗效应,并揭示了外泌体ANGPTL4蛋白是其中的关键信号分子。该研究为肺癌的分子靶向治疗与放疗的联合运用提供了的新的探索途径。

肺癌是对人群生命健康以及社会负担影响最大的恶性肿瘤,已成为全球癌症死因的第一位,放疗作为肺癌治疗的主要手段已经取得实质性的进展,但放疗抵抗仍是部分患者放疗后预后不良与复发的主要原因。乏氧是肿瘤微环境中最为显著的特征,长期以来一直被认为是导致实体肿瘤辐射抵抗最为关键的因素。近年来,作为肿瘤微环境中的主要组成部分,外泌体在肿瘤发生发展中的作用引起了越来越多的关注;特别是在乏氧肿瘤微环境中,肿瘤来源的外泌体能够向肿瘤细胞和基质细胞传递特异的生物信号,在介导肿瘤细胞之间、肿瘤与正常组织之间的信息交流中发挥重要作用。因此,探究引起肺癌放疗抵抗的调控基因及相关机制,降低肺癌放疗抗性,对改善肺癌放疗疗效与预后至关重要。
近日,放医所研究生张育红等人通过一系列实验证明,乏氧能显著促进肺癌细胞中ANGPTL4蛋白的表达并在外泌体中富集,其表达水平与肺癌细胞的辐射抵抗呈正相关,而乏氧外泌体可运载ANGPTL4蛋白至常氧肿瘤旁细胞,引起其辐射抵抗。进一步研究发现,乏氧可促进肺癌细胞中铁死亡抑制性调节蛋白GPX4、SLC7A11等的表达,减少脂质过氧化作用并抑制铁死亡,进而介导肺癌的辐射抵抗效应;而过表达或敲低ANGPTL4的表达,可分别抑制或激活铁死亡信号通路。同时,载有较高水平ANGPTL4蛋白的乏氧外泌体可显著促进周围常氧肿瘤细胞内ANGPTL4的表达,抑制铁死亡信号通路。
这些研究表明,乏氧诱导的ANGPTL4蛋白至少通过两条平行的途径促进肺癌的辐射抵抗作用。首先,乏氧可促进肺癌细胞ANGPTL4蛋白表达和分泌,抑制铁死亡通路、介导辐射抵抗。此外,分泌型ANGPTL4蛋白能够装载于乏氧肿瘤细胞衍生的外泌体中,稳定地传递给周围常氧区的肿瘤细胞,以乏氧外泌体-ANGPTL4-GPX4依赖性机制,抑制常氧区肿瘤细胞的铁死亡通路,诱导这些细胞对辐射产生抵抗,进而将乏氧区肿瘤细胞的辐射抵抗效应传递给常氧区肿瘤细胞。该研究所揭示的细胞内ANGPTL4蛋白和乏氧外泌体ANGPTL4蛋白在乏氧肿瘤微环境中诱导辐射抵抗的作用机制,因此,靶向ANGPTL4可能是一种改善肺癌放疗疗效的新治疗策略。
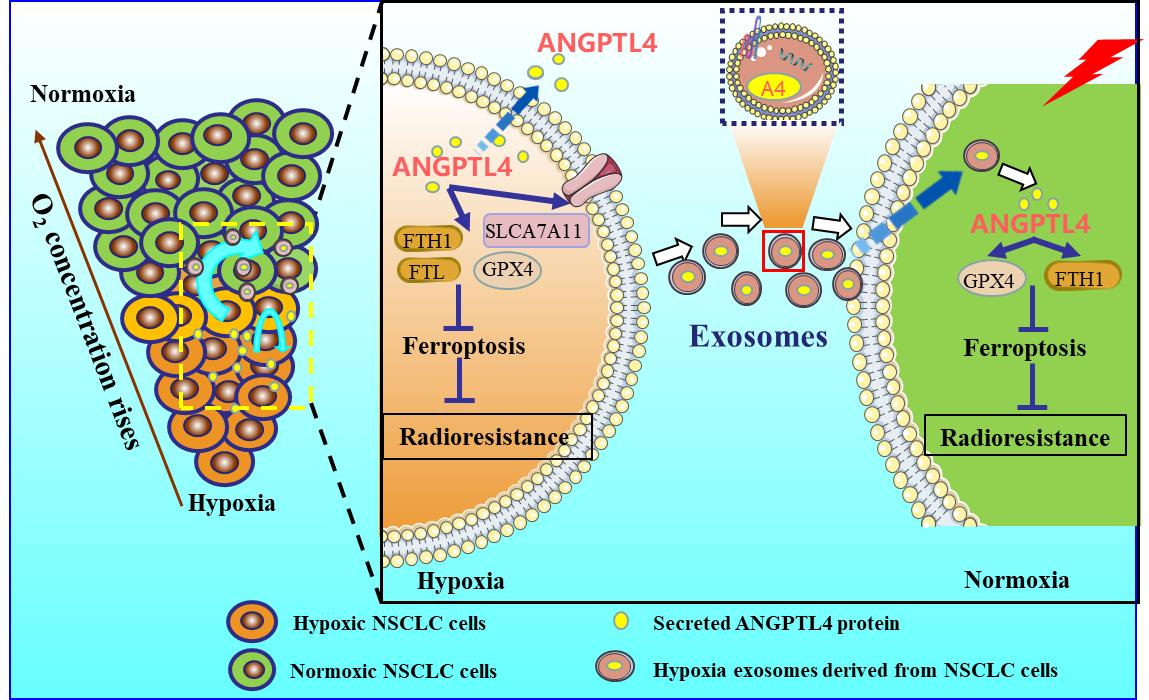
图:乏氧微环境中 ANGPTL4 通过抑制肺癌细胞铁死亡促进辐射抵抗的机制图
复旦大学放射医学研究所研究生张育红为论文的第一作者,张江虹副研究员是该文的首要通讯作者,邵春林研究员是共同通讯作者。该研究获得了国家自然科学基金、上海市科委科研计划重点项目的资助。
原文链接:https://www.nature.com/articles/s41416-022-01956-7



