放射治疗是肿瘤临床治疗的重要手段之一,患者肿瘤受到精准照射后会因细胞死亡而消减,同时,照射野外的转移瘤瘤体也可能缩小甚至消退,但肿瘤周围和远端正常组织也会产生一系列生物效应,这些照射视野外的生物效应称为辐射远端效应(radiation-induced abscopal effect, RIAE)。目前,RIAE的发生机制已成为肿瘤放射生物学领域的研究热点之一。
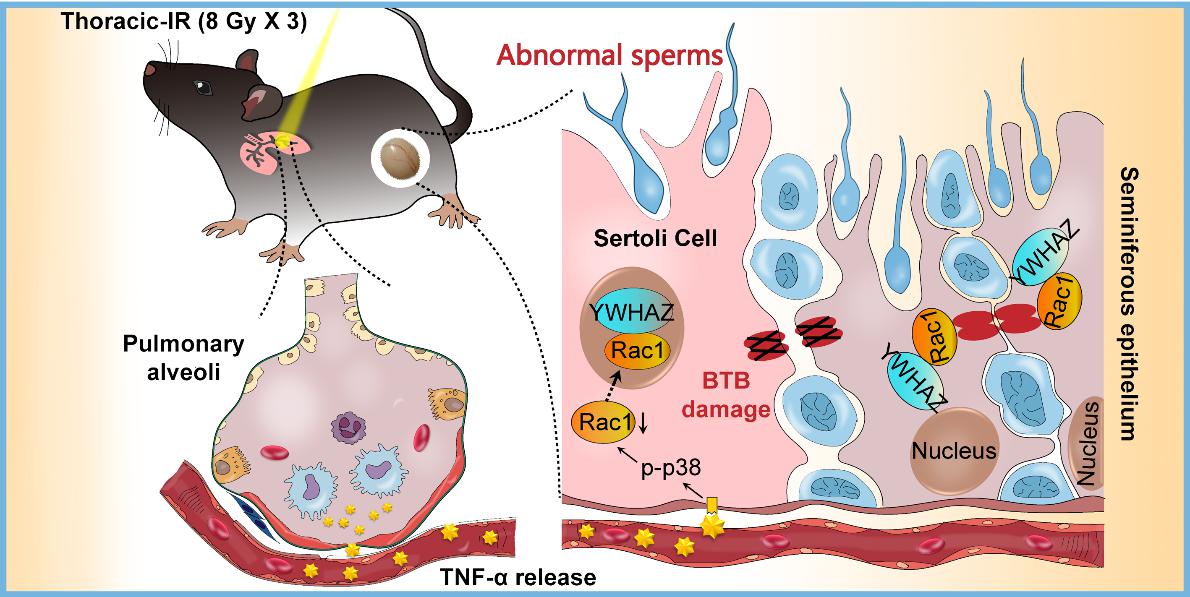
近日,复旦大学放射医学研究所博士研究生胡松玲等人研究发现,雄性小鼠右胸大剂量分割照射后可以引起远端未受照射睾丸组织超微结构的破坏,血睾屏障(blood testis barrier, BTB)紧密连接相关蛋白ZO-1及Occludin完整性丧失;辐射后两周,小鼠精子数量、精子活力及配对雌鼠受孕率显著降低,产生显著的远端生殖损伤效应。机制研究表明,胸部辐照可以释放促炎因子TNF-α,引起远端未受照射睾丸组织中p38发生磷酸化;首次发现睾丸支持细胞(Sertoli cell,SC)极性蛋白YWHAZ可与Rac1蛋白发生共定位,并驱动了Rac1蛋白的核转移,使SC骨架蛋白F-actin和α-tubulin与Rac1发生解离,导致生精小管的极性支撑功能丧失,引起BTB结构的破坏;而照射时给予小鼠TNF-α特异性抑制剂,可以有效降低或消除该辐射远端效应,表明炎性因子TNF-α是诱发辐射远端遗传损伤效应的重要信号因子。这些发现提示我们,胸部放疗对育龄期男性患者存在遗传毒副作用的隐患,放疗前通过适当的药物干预有可能在保证放疗效果的同时最大程度的减少远端生殖系统的损伤,这对提升肿瘤放疗的生物安全性具有重要意义。
上述研究结果已发表于Theranostics 2021, 11(12): 5742 (IF=11.56),邵春林研究员是该文的首要通讯作者。