
2023年6月26日,复旦大学放射医学研究所邵春林研究员团队在 《Theranostics》(2023 IF: 12.4)上在线发表题为 “SDC1-TGM2-FLOT1-BHMT complex determines radiosensitivity of glioblastoma by influencing the fusion of autophagosomes with lysosomes”的研究论文,揭示辐射可以引起胶质母细胞瘤(GBM)细胞中SDC1-TGM2-FLOT1-BHMT蛋白复合体的形成,促进自噬体-溶酶体的融合,并阐明该蛋白复合体在提高GBM辐照后的自噬水平、介导辐射抵抗中的效果与作用机制,为胶质母细胞瘤放疗提供了新的潜在增敏靶点。
胶质母细胞瘤是中枢神经系统最常见、最致命的原发性恶性肿瘤,具有高复发率和高死亡率,放射治疗是其重要治疗手段之一,可在一定程度提高患者生存率。然而,胶质瘤具有辐射抗性性,常常导致放疗预后不良。深入挖掘关于GBM放疗耐受的关键基因并明确其调控机制,不仅可以从细胞及分子水平系统揭示辐射耐受的深层机理,更有望通过靶向调控这些关键的基因或蛋白,提胶质瘤患者放疗疗效,有效改善患者预后。
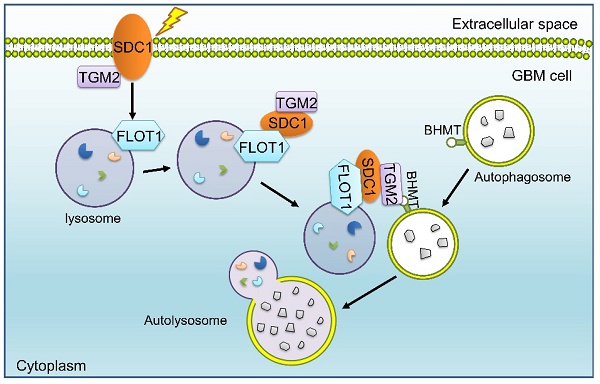
Syndecan 1(SDC1)是I型单跨膜蛋白聚糖之一,在促进肿瘤发生和转移方面具有重要作用;TGM2 是一种转谷氨酰胺酶,在发育过程中调节多种细胞过程;Flotillin 1(FLOT1)是脂筏的重要标志物,参与细胞增殖、迁移、细胞粘附、存活、分化、内吞、信号转导和膜运输等多种过程,它们均可促进自噬的启动;甜菜碱同型半胱氨酸甲基转移酶(BHMT)也是自噬体胞质蛋白之一,可作为自噬的生物标志物。自噬在维持肿瘤细胞存活、导致放疗抵抗和恶性肿瘤复发过程中发挥着重要作用。
邵春林团队之前的研究表明,GBM细胞表面的SDC1可以将TGM2从细胞膜携带到溶酶体(姐妹篇论文,Autophagy, 2023, 19(3): 839–857, https://doi.org/10.1080/15548627.2022.2105562),但尚不清楚溶酶体上的哪个分子直接与SDC1结合。本研究发现,受辐射后,GBM细胞膜SDC1、TGM2发生细胞质转移,SDC1蛋白的细胞质结构域与溶酶体表面蛋白FLOT1相结合,进一步地,TGM2可识别自噬体膜上的BHMT,形成SDC1-TGM2-FLOT1-BHMT四聚体,促进溶酶体和自噬体融合,增强GBM的辐射抵抗性。在此过程中,SDC1是SDC1-TGM2-FLOT1-BHMT共聚物整个形成过程中的关键引发剂,因此,靶向SDC1的药物与放疗联合治疗有可能成为胶质瘤治疗的一种潜在优势策略。
复旦大学放射医学研究所博士研究生曾靓、郑旺、刘兴隆为论文的共同第一作者,邵春林研究员为该论文的通讯作者。该研究获得了国家自然科学基金重点项目的资助。
原文链接:https://www.thno.org/v13p3725.htm



