天然铀是核工业中核燃料生产的重要原料,贫铀是核燃料生产过程中的副产物,其在军事和民用领域亦有较多用途。一旦发生核事故或环境污染,铀通过呼吸道、消化道和伤口进入人体造成以化学毒性为主的健康危害。肾脏是人体铀中毒的蓄积/毒性靶器官,其中肾近端小管上皮细胞是铀蓄积/毒性的主要靶细胞。蓄积于细胞内的铀难以被清除是当前急性铀中毒延迟治疗和慢性铀中毒治疗面临的关键难题。
复旦大学放射医学研究所陈红红研究员课题组从溶酶体胞吐的全新视角,揭示激活TRPML1促进溶酶体胞吐及生成能显著促进蓄积于肾组织/近端小管上皮细胞内铀的排出及减轻铀致肾近端小管上皮细胞损伤/死亡,该研究为急/慢性铀中毒的促排和解毒治疗提供了新的治疗策略。研究结果于2023年7月6日以题为“Induction of lysosomal exocytosis and biogenesis via TRPML1 activation for the treatment of uranium-induced nephrotoxicity”的研究论文在线发表在《Nature Communications》(2022-2023 IF: 16.6)杂志上。

该项研究突破了常规采用螯合剂治疗放射性核素内污染的治疗模式,独辟蹊径,依据多项研究报道“肾近端小管上皮细胞及其他类型细胞暴露于细胞毒性浓度的可溶性铀后,其溶酶体中可形成针形磷酸铀晶体沉淀”的这一现象,创新性地提出“促进溶酶体胞吐可加速清除细胞内蓄积铀”的科学假说。该研究聚焦调控溶酶体胞吐功能的关键蛋白——溶酶体Ca2+释放通道TRPML1,发现TRPML1的特异性小分子激动剂ML-SA1延迟给药能显著增强肾近端小管上皮细胞的溶酶体胞吐/生成作用,从而发挥促进细胞内铀排出及减轻铀诱导的溶酶体膜通透化及细胞死亡的双重功能;同时发现激活TRPML1-转录因子EB(TFEB)正反馈环路诱导溶酶体Ca2+释放介导的溶酶体胞吐及维持溶酶体库稳态是其重要的作用机制。该研究为急/慢性铀中毒的促排/解毒药物研发提供了新的启示,揭示TRPML1是一个有希望的药物新靶点,亦对其他有害金属肾毒性的解毒药物研发具有很好的借鉴意义。
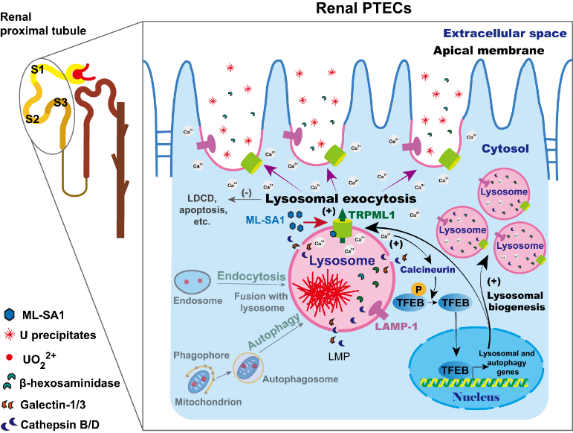
图:TRPML1激动剂ML-SA1促进肾近端小管上皮细胞内蓄积铀及损伤溶酶体清除的机制图
复旦大学放射医学研究所硕士研究生钟登琴、王睿云、张洪静为本文的共同第一作者,陈红红研究员为通讯作者。该研究获得了国家自然科学基金面上项目的资助。
文章链接:https://doi.org/10.1038/s41467-023-39716-7



